Objawy niedoborów składników pokarmowych
Azot (N)
Pierwsze objawy niedoboru obserwujemy na starszych liściach, z czasem obejmują liście wyżej położone na pędzie.
- Małe jasnozielone liście,
- Cienkie pędy, szybko kończące swój wzrost,
- Ograniczone zawiązywanie pąków kwiatowych,
- Drobne i niesmaczne owoce pomimo dobrego wybarwienia,
- Owoce z tendencją do wcześniejszego dojrzewania i opadania.
Fosfor (P)
Objawy niedoboru występującego w okresie wiosenno-letnim widoczne są w pierwszej kolejności na starszych liściach. Natomiast w okresie letnio-jesiennym objawy występują zwykle na liściach młodych, sąsiadujących z pąkiem wierzchołkowym.
- Karminowo-bordowe przebarwienia liści i/lub przebarwienia nerwów głównych na kolor fioletowy,
- Liście sztywne i osadzone na pędach pod ostrym kątem,
- Osłabienie wzrostu pędów,
- Krótkie i grube pędy,
- Zamieranie pąków kwiatowych,
- Drobne, niesmaczne i słabo wybarwione owoce o obniżonej zdolności przechowalniczej.
Potas (K)
W pierwszej kolejności objawy niedoboru potasu pojawiają się na starszych liściach.
- Małe liście,
- Chlorotyczne plamy pomiędzy nerwami oraz na brzegach liści przy silnym niedoborze.
- Z czasem chloroza liści przechodzi w nekrozę, a brzegi liści podwijają się do góry. Przy silnym deficycie potasu nekroza obejmuje całą powierzchnię blaszki liściowej,
- Krótkie, cienkie pędy podatne na przemarzanie,
- Słabo wybarwione, drobne owoce.
Magnez (Mg)
- Chlorotyczne plamy pomiędzy głównymi nerwami liści, które następnie przechodzą w nekrozę,
- Liście z silnymi objawami niedoboru szybko zasychają i opadają. Na pędach pozostają tylko wierzchołkowe liście,
- Obniżona wytrzymałość drzew na niskie temperatury,
- Niesmaczne, drobne i słabo wybarwione owoce o obniżonej trwałości pozbiorczej,
- Owoce z tendencją do wcześniejszego dojrzewania i opadania.
Wapń (Ca)
- Jasnozielone wierzchołkowe liście z plamkami o barwie żółto-brązowej. Brzegi liści mogą być postrzępione lub podwijać się do góry (takie symptomy zwykle obserwujemy na truskawce, gdyż w uprawach drzew owocowych objawy na częściach wegetatywnych występują rzadko),
- Drobne owoce podatne na pękanie, korkowacenie i oparzenia słoneczne,
- Owoce krócej się przechowują i są bardziej podatne m.in. na: gorzką plamistość podskórną, szklistość miąższu, rozpad wewnętrzny, skorkowacenie miąższu, lucernowatość miąższu.
Bor (B)
- Liście wierzchołkowe chlorotyczne, kruche, wąskie, z nekrozami na brzegach,
- Nieprawidłowy rozwój pąków kwiatowych, a nawet zamieranie kwiatów, zwłaszcza u grusz,
- Zahamowanie wzrostu pędów,
- Zamieranie wierzchołków pędów,
- Nekrozy i łuszczenie się kory na pniach,
- Słabe kwitnienie. Brak zapłodnienia po zapyleniu,
- Drobne, zniekształcone owoce z ordzawioną i skorkowaciałą skórką, z tendencją do pękania,
- Owoce przedwcześnie dojrzewają i opadają.
Żelazo (Fe)
- Na najmłodszych liściach – objawy chlorozy międzyżyłkowej – nerwy główne pozostają zielone,
- Żółte liście wierzchołkowe z nekrotycznymi plamami na brzegach liści,
- Blaszki liściowe wygięte do góry wzdłuż nerwu głównego,
- Zahamowany wzrost pędów,
- Zamieranie wierzchołków pędów oraz całych konarów (bardzo duży niedobór).
Mangan (Mn)
- Chloroza pomiędzy głównymi nerwami liści, rozpoczynająca się od brzegów blaszki liściowej na liściach w środkowej części długopędów,
- Zahamowany wzrost pędów,
- Drobne owoce.
Cynk (Zn)
- Rozetowatość liści wierzchołkowych. Wąskie, małe liście, osadzone blisko siebie na pędzie,
- Chlorozy na liściach, na ich brzegach i pomiędzy głównymi nerwami,
- Zamieranie wierzchołków pędów (silny niedobór),
- Owoce drobne i asymetryczne.
Siarka (S)
- Jasnozielone liście wierzchołkowe,
- Zahamowanie wzrostu części nadziemnych roślin,
- Kruchość pędów i liści,
- Obniżona odporność drzew na stresy abiotyczne,
Miedź (Cu)
- Małe, łódkowate liście wierzchołkowe, z czasem brązowiejące i zamierające,
- Opóźnione kwitnienie i słabe zawiązywanie owoców,
- „Czarcie miotły” – wybijanie pąków z jednorocznych przyrostów oraz dwuletnich pędów
(silny niedobór).
Molibden (Mo)
- Drobne i pomarszczone liście wierzchołkowe z drobnymi plamami nekrotycznymi,
- Mniejsza zawartość nasion w owocach.
Metoda Holza
Najdokładniejszą lustrację zimową sadu lub jagodnika przeprowadza się dwuetapowo. Najpierw należy dokładnie przyjrzeć się sytuacji w sadzie na miejscu. W czasie lustracji plantacji należy pobrać materiał w celu dalszej dokładnej oceny. Materiał pobiera się według zaleceń z metody Holza.
Pobieranie prób w sadzie:
- wybrać losowo 10 drzew tej samej odmiany,
- z każdego z drzew wyciąć po 2 fragmenty pędów:
- długość fragmentów pędów – ok. 20 cm,
- pędy 2-letnie z krótkopędami,
- pobierane z różnych wysokości korony,
- o średnicy do 1 cm,
- można wybierać również pędy z popękaną lub uszkodzoną korą,
- dodatkowo z każdego z drzew wyciąć po 1 fragmencie pędu 1-rocznego,
- zebrane pędy związać, zapakować do plastikowego worka i opisać (pędy 1-roczne oddzielnie):
- imię i nazwisko, kontakt (np. tel.),
- odmiana jabłoni,
- wiek drzew i powierzchnia sadu/kwatery,
- przed dostarczeniem do analizy przechowywać pędy w chłodni lub na zewnątrz w niskiej temperaturze,
- dostarczyć do analizy lub wykonać analizę samodzielnie z wykorzystaniem binokularu.
Mikrobiologiczne żywienie roślin
Na efektywne żywienie roślin ma wpływ szereg czynników, m.in. jakość i ilość składników odżywczych, obecność i skład życia mikrobiologicznego, parametry gleby lub podłoża, warunki pogodowe, rodzaj uprawianej rośliny, metody uprawy itp.
Nawożenie mineralne to najszybsza metoda dostarczania dużej liczby makro- i mikroelementów do gleby. Jednak mimo wprowadzania optymalnej lub nawet nadmiernej ilości składników odżywczych do gleby, często nie są one pobierane w wystarczającej ilości przez rośliny. W wielu przypadkach związki pokarmowe występują lub przechodzą w formy niedostępne dla roślin pod wpływem różnych czynników. Zastosowanie pożytecznych mikroorganizmów glebowych nie tylko przyczynia się do zwiększenia efektywności pobierania składników pokarmowych ale również do ich przemiany z form niedostępnych dla roślin do form dostępnych i łatwo przyswajanych.
Stosowanie nadmiernych ilości nawozów mineralnych może prowadzić do niekorzystnych zmian nie tylko w glebie, ale również w środowisku. Dlatego coraz większe znaczenie zyskują metody rewitalizacji gleb, połączone z możliwością ograniczenia nawożenia mineralnego roślin. Jedną z nich jest stosowanie pożytecznych mikroorganizmów glebowych w połączeniu z żywieniem mineralnym i organicznym.
Pożyteczne mikroorganizmy glebowe nie są traktowane jako
nawozy, jednak przez specyficzne oddziaływanie na korzenie roślin oraz na
podłoże otaczające ich system korzeniowy istotnie wpływają na efektywność
nawożenia. Bakterie glebowe Azotobacter
chroococcum (Free N 100) w ciągu życia wiążą azot atmosferyczny, a w
trakcie zamierania są źródłem tego składnika pokarmowego dla roślin. Bakterie Bacillus muscilaginosus (Free PK) przez
swoje zdolności do przekształcania składników odżywczych niedostępnych dla
roślin w formy przyswajalne wpływają na poprawę ich odżywienia
w fosfor, potas, wapń i składniki odżywcze. Z kolei Bacillus ameloliquefaciens (RhizoVital 42) zasiedla strefę
korzeniową roślin oraz wpływa na wytwarzanie enzymów i innych związków wpływających
na szybszy rozwój systemu korzeniowego, lepsze przyswajanie fosforu czy
stymulację systemu odpornościowego roślin na stres biotyczny i abiotyczny.
Dodatkowo zastosowanie mikroorganizmów ogranicza organizmom patogenicznym dostęp do korzeni roślin, co minimalizuje ryzyko ich porażenia. Mikroorganizmy rozwijające się intensywnie wokół systemu korzeniowego nie tylko nie pozostawiają miejsca do rozwoju patogenów, ale również wydzielają związki, które mogą odstraszać lub zniechęcać do żerowania niektóre szkodniki, np. nicienie (Bacillus ameloliquefaciens – RhizoVital 42).
Zasady montażu i obserwacji pułapek feromonowych typu Delta
Do przesyłania informacji miedzy owadami w naturze często służą związki chemiczne przez nie wytwarzane. Feromony są wyczuwane przez owady z dalekich odległości, kilkudziesięciu, a nawet kilkuset metrów. Zwykle są specyficzne dla konkretnych gatunków lub gatunków bardzo blisko z sobą spokrewnionych. Dzięki swoim specyficznym cechom feromony wykorzystywane są w systemach monitoringu i diagnostyki.
Zastosowanie pułapek feromonowych:
- Określenie obecności szkodnika na danym terenie (np. sadzie, winnicy, lesie).
- Określenie wielkości populacji szkodnika.
- Określenie terminu wylotu oraz szczytu lotu szkodnika.
Na system monitoringu przy użyciu pułapek typu DeltaStop składa się kilka elementów:
- dyspenser feromonowy – jest to niewielki koreczek, szczelnie zamknięty w specjalnie dopasowanym do niego opakowaniu. Dyspensery przechowywane w stanie zamrożenia, w nienaruszonym opakowaniu, nie tracą swojej użyteczności. Substancja (feromon), którą nasączony jest dyspenser jest niezwykle lotna, choć dla człowieka pozostaje niewyczuwalna, łatwo roznosi się w powietrzu,
- plastikowa pułapka typu DelaStop – w kształcie daszka, do wielokrotnego użytku,
- wymienne podłogi lepowe,
- drucik do zaczepienia pułapki oraz metka, na której należy opisać organizm, którego dotyczy pułapka.
Montaż pułapki:
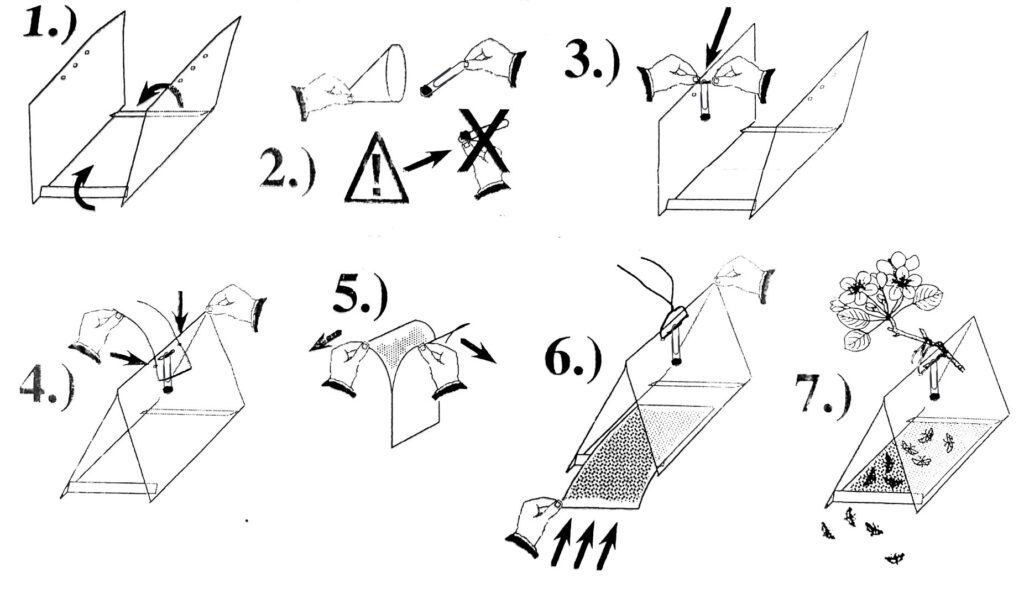
- Plastikową pułapkę należy złożyć tak, aby tworzyła daszek z podłogą.
- Dyspenser feromonowy należy wyjmować z opakowania ostrożnie, najlepiej za pomocą pincety. Feromon nie jest szkodliwy dla człowieka, jednak substancja w nim zawarta jest na tyle lotna, że może przenosić się z palców na zewnętrzne części pułapki, lub rośliny sąsiednie w czasie montażu. Należy również pamiętać o dokładnym oczyszczeniu pincety oraz rąk po montażu każdego z feromonów w przypadku, gdy jednocześnie montujemy kilka pułapek.
- Dyspenser należy zamontować w pułapce, np. na druciku. Ważne, aby dyspenser znajdował się w środku pułapki.
- Do pułapki zamontować drucik, na którym później będzie można zawiesić pułapkę w sadzie.
- Rozdzielić podłogi lepowe. Jedną z podług można zabezpieczyć kawałkiem folii do czasu jej użycia.
- Podłogę lepową wsunąć do pułapki lepką stroną do góry.
- Pułapka jest gotowa do zawieszenia.
Ilość i rozmieszczenie pułapek w sadzie:
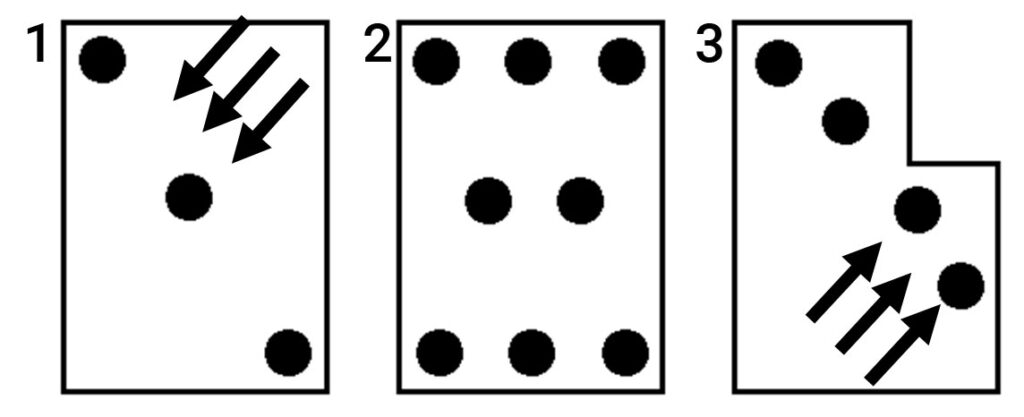
Przed zamieszczeniem pułapek w sadzie należy je odpowiednio złożyć oraz zamontować dyspenser wyjęty bezpośrednio z opakowania, a na dnie pułapki zamontować podłogę lepową. Wysokość, na jakiej zawieszono pułapkę, może mieć decydujący wpływ na jakość jej działania. W sadach pułapki należy montować na wysokości oczu (około 160 cm nad ziemią), w winnicach w górnej części konstrukcji (około 120 cm nad ziemią), w uprawach polowych tak, aby otwór pułapki był na wysokości poziomu roślin. Jeżeli etykieta konkretnej pułapki nie mówi inaczej, pułapki należy stosować na jednorodnych obszarach (tzn. jednakowa roślina, jednakowy kształt terenu i warunki mikroklimatyczne), co najmniej 3 pułapki na danym obszarze (rys.1). Wiarygodne informacje dadzą pułapki rozmieszczone w odpowiedni sposób, przy zewnętrznych krawędziach i na środku obszaru (rys.2.).
Informacje o nalocie szkodników z zewnątrz pola
zapewniają pułapki umieszczone na zewnętrznych krawędziach. Planując
rozmieszczenie pułapek należy brać pod uwagę sytuację panującą
w poprzednich latach i zamieszczać pułapki w miejscach, gdzie wcześniej
pojawiały się szkodniki (rys.3.). Kilka (1 – 6 pułapek) na 1 h można rozłożyć
w przypadku, kiedy chce się określić występowanie ognisk szkodnika. W celu
ograniczenia liczby pułapek należy umieścić je po przekątnej pola prostopadle
do kierunku wiatru (rys.1.). Należy zachować odpowiednią odległość między
pułapkami – co najmniej 50 m. Do monitoringu powierzchni małych (poniżej 1 ha),
ogrodów, można stosować pułapki w odległościach mniejszych niż 50 m.
Termin wywieszania pułapek:
Pułapki należy wywiesić na tydzień przed teoretycznym rozpoczęciem lotu szkodnika. Termin wywieszenia pułapek jest bardzo ważny i wpływa na skuteczność działania pułapki. Terminy lotów szkodników są podawane w opisach ich biologii. Zaleca się stosować monitoring do końca sezonu (końca zbiorów).
| Szkodnik | L. pokoleń | Przybliżony termin lotu osobników dorosłych | Termin zawieszania pułapek |
| zwójka siatkóweczka (Adoxophyes orana) | 2 | I pokolenie – druga i trzecia dekada maja II pokolenie – druga połowa lipca i w sierpniu | Na około tydzień przed spodziewanym lotem szkodnika |
| owocówka śliwkóweczka (Cydia funebrana) | 2 | I pokolenie – w pierwszej połowie maja II pokolenie – druga dekada lipca | |
| owocówka jabłkóweczka (Cydia pomonella) | 2 | I pokolenie – w połowie maja II pokolenie – druga połowa czerwca | |
| zwójka bukóweczka (Pandemis heparana) | 2 | I pokolenie – na początku czerwca II pokolenie – koniec drugiej połowy sierpnia | |
| wydłubka oczateczka (Spilonota ocellana) | 1 | początek czerwca |
Monitorowanie pułapek:
Pułapki, od momentu ich wywieszenia aż do końca
lotu szkodnika, należy kontrolować codziennie,
a w dalszym okresie raz na 2 tygodnie. Należy dokładnie sprawdzać lepką podłogę
pułapki
i dokładnie oznaczać znajdujące się tam owady, usuwać zanieczyszczenia i
odłowione owady
z pułapki. Zużyte podłogi lepowe należy wymienić na nowe.
Dyspensery feromonowe należy wymieniać co 6 – 8 tygodni. Przy monitorowaniu szkodników, które pojawiają się w długim okresie, należy wymieniać dyspenser feromonowy wraz z podłogą lepową pułapki. Pod koniec sezonu należy usunąć lepowe podłogi i dyspensery, można je utylizować jako odpady komunalne. Należy zapisywać terminy wywieszania pułapek i zmian dyspenserów oraz prowadzić rejestr terminów, w których pojawiały się szkodniki.
Interpretacja dzienników połowowych:
Dane z pułapek należy zapisywać w formie tabel i przedstawiać je na wykresach. Tak zebrane informacje ułatwiają podjęcie decyzji o terminie zabiegu ochronnego. Określanie terminu zabiegu może bezpośrednio zależeć od danych z dzienników połowowych, takich jak loty samców. Informacje pozyskane z pułapek mogą służyć również do innych metod produkcji i kontroli (np. określania liczby składanych jaj). Szczegółowe zasady stosowania pułapek feromonowych zależne są od gatunku szkodnika. Pozwalają na określenie progów zwalczania szkodników, poza którymi walka z nimi nie będzie opłacalna ekonomicznie, a stopień nasilenia szkodnika nie będzie zagrażał produkcji.
